Cerhlaguna.com
37412_SpanishCover:37412_SpanishCover 9/17/09 10:37 AM Page 1
Publicado por la American Society for Reproductive Medicine, bajo la dirección
del Comité de Educación del Paciente y el Comité de Publicaciones. Ninguna
parte en este documento puede ser reproducida en ninguna forma sin permiso
por escrito. Este folleto no pretende de ninguna manera sustituir, dictar ni definir
totalmente la evaluación y el tratamiento por parte de un médico calificado.
Está destinado exclusivamente como una ayuda para los pacientes que buscan
información general sobre temas relacionados con la medicina reproductiva.
Copyright 2008 por la American Society for Reproductive Medicine.
AMERICAN SOCIETY FOR REPRODUCTIVE MEDICINE
REPRODUCCIÓN ASISTIDA
Guía para pacientes
Un glosario de las palabras en cursiva se encuentra al final de este folleto.
Este folleto le ayudará a comprender la
fertilización in vitro (
FIV) y otras
tecnologías
de reproducción asistida (
TRA) que se han convertido en tratamientos médicos aceptados
para la infertilidad. A través de estos procedimientos, muchas parejas con infertilidad de
otra manera intratable han dado a luz bebés sanos.
Reproducción sin ayuda
A fin de entender la reproducción asistida y la forma en que esta puede ayudar a las
parejas infértiles, es importante comprender cómo se l eva a cabo la concepción natural.
Para que se produzca la concepción tradicional, el hombre debe eyacular su
semen,
el líquido que contiene los
espermatozoides, en la
vagina de la mujer aproximadamente
en el momento de la
ovulación, cuando uno de los
ovarios de el a libera un
óvulo. La
ovulación es un evento complejo controlado por la
glándula pituitaria, que está ubicada
en la base del cerebro. La glándula pituitaria libera la
hormona foliculoestimulante (
HFE)
,
que estimula los folículos en uno de los ovarios para que empiecen a crecer. El
folículo
produce la hormona
estrógeno y contiene un óvulo en maduración. Cuando un óvulo
madura, la glándula pituitaria envía una oleada de hormona luteinizante (HL) que hace
que el folículo se rompa y libere (ovule) un óvulo maduro (figura 1).
Después de la ovulación, el óvulo es recogido por una de las
trompas de Falopio.
Dado que la
fertilización generalmente tiene lugar en el interior de la trompa de Falopio,
el espermatozoide del hombre debe ser capaz de nadar a través de la vagina y la
mucosa
cervical, subir por el
canal cervical en el
útero y llegar al interior de la trompa de
Falopio, donde debe penetrar el óvulo con el fin de fecundarlo. El óvulo fecundado
continúa viajando al útero y se implanta en el revestimiento uterino, donde se sigue
La fertilización
Trompa de Falopio
generalmente se
produce aquí,
en la trompa de
Cuel o uterino
Mucosa cervical
Las flechas sólidas indican el recorrido que el espermatozoide debe hacer para l egar al
óvulo. La flecha punteada indica el recorrido del óvulo. El óvulo fecundado continúa
viajando a través de la trompa de Falopio hasta el útero.
FERTILIZACIÓN IN VITRO (FIV)
Existen muchos factores que pueden impedir la unión del espermatozoide y el óvulo,
y estos se analizan en el fol eto de información para pacientes de la ASRM titulado
La infertilidad, una visión general. Afortunadamente, las técnicas de reproducción asistida
como la FIV pueden ayudar. La FIV es un método de reproducción asistida en el que el
espermatozoide de un hombre y el óvulo de una mujer se combinan fuera del cuerpo, en
una placa de laboratorio. Uno o más óvulos fecundados (
embriones) pueden ser transferidos
al útero de la mujer, donde tal vez se implanten en el revestimiento uterino y se desarrol en.
Los embriones que sobran pueden ser
crioconservados (congelados) para un uso futuro.
Inicialmente, la FIV se utilizó para tratar a las mujeres con trompas de Falopio bloqueadas,
dañadas o ausentes. Hoy en día, la FIV se utiliza para tratar muchas causas de infertilidad,
como la
endometriosis y el
factor masculino, o cuando la infertilidad de una pareja es
Los pasos básicos en un ciclo de tratamiento de FIV son la
estimulación ovárica,
la
recuperación de óvulos, la fertilización, el
cultivo de embriones y la
transferencia
de embriones. Estos temas se analizarán en las siguientes secciones.
Durante la estimulación ovárica, también conocida como
inducción de la ovulación,
se utilizan medicamentos o "fármacos para la fertilidad" para estimular el crecimiento
de múltiples óvulos en los ovarios en lugar del óvulo único que normalmente se
desarrol a cada mes (cuadro 1). Se estimulan varios óvulos, ya que algunos no se
fecundan ni se desarrol an normalmente después de la fertilización. El número máximo
de embriones transferidos depende de la edad de la paciente y de otras características
individuales de la paciente y de los embriones. Dado que cada embrión tiene una4
probabilidad de implantación y de desarrol o, el número de embriones destinados a ser
colocados se determinará para cada paciente, teniendo en cuenta las probabilidades de
lograr un embarazo en función del número de embriones transferidos sopesadas frente
al riesgo de una gestación múltiple (cuadro 1).
Medicamentos para la estimulación ovárica
• Citrato de clomifeno (Clomid®, Serophene®)
• Letrozol (Femara)
• Hormona foliculoestimulante (HFE) (Fol istimTM, Gonal-F®, Bravel eTM)
• Gonadotropinas menopáusicas humanas (GMh) (HumegonTM, RepronexTM, Menopur®)
• Hormona luteinizante (HL) (Luveris®)
Medicamentos para la maduración de ovocitos
• Gonadotropina coriónica humana (GCh) (Profasi®, APL®, Pregnyl®, NovarelTM, Ovidrel®)
Medicamentos para prevenir la ovulación prematura
• Agonistas de HLGn (Lupron® y Synarel®)
• Antagonistas de HLGn (Antagon®, Ganarelix® y Cetrotide®)
El citrato de clomifeno se administra por vía oral, mientras que los otros
medicamentos indicados se administran mediante inyección. El citrato de clomifeno
es menos potente que los medicamentos inyectables y no es tan comúnmente utilizado
en los ciclos de TRA. No hay pruebas de que un medicamento inyectable sea superior
a otro. Para más información, consulte otro fol eto de la serie de información para
pacientes de la ASRM titulado Medicamentos para la inducción de la ovulación.
Determinar el momento apropiado es crucial en un ciclo de FIV. Los ovarios son
evaluados durante el tratamiento con ecografías vaginales para controlar el desarrol o
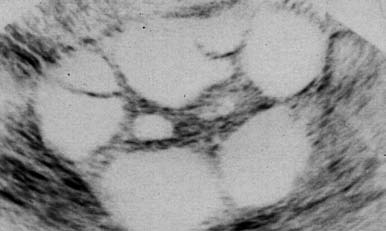
de los folículos ováricos (figura 2). Se pueden tomar muestras de sangre a fin de medir
la respuesta a los medicamentos para la estimulación ovárica. Normalmente, los niveles
de estrógeno aumentan a medida que los folículos se desarrol an y los niveles de
progesterona son bajos hasta después de la ovulación.
Folículos ováricos, estimulados por fármacos
para la ovulación, vistos en una ecografía. Las
zonas oscuras y circulares son los folículos.
Con el uso de ecografías y de análisis de sangre, el médico puede determinar cuándo
los folículos están listos para la recuperación de óvulos. Por lo general, son necesarios
de 8 a 14 días. Cuando los folículos están listos, se administra GCh u otros medicamentos.
La GCh sustituye la secreción natural de HL de la mujer y ocasiona la fase final de
maduración de los óvulos de manera que sea posible fecundarlos. Los óvulos son
recuperados antes de que la ovulación se produzca; por lo general 34 a 36 horas
después de administrada la inyección de GCh.
Hasta el 20% de los ciclos pueden ser cancelados antes de la recuperación de óvulos.
Los ciclos de FIV pueden ser cancelados por una variedad de razones, generalmente
debido a un número insuficiente de folículos en desarrol o. Las tasas de cancelación
debido a bajas respuestas a los fármacos para la ovulación aumentan con la edad,
especialmente después de los 35 años. Cuando los ciclos se cancelan debido a una
respuesta pobre, pueden ser útiles estrategias alternativas con fármacos para promover
una mejor respuesta en un intento futuro. Ocasionalmente, un ciclo se puede cancelar
para reducir el riesgo del síndrome de hiperestimulación ovárica (SHO).
El tratamiento con un agonista o antagonista de HLGn reduce la posibilidad de
aumentos prematuros de HL de la glándula pituitaria y, por lo tanto, reduce el riesgo
de una ovulación prematura. Sin embargo, en los ciclos de TRA se producen aumentos
de HL y ovulación prematura en un pequeño porcentaje, a pesar de la utilización de estos
fármacos. Cuando esto ocurre, ya que no se sabe cuándo comenzarán los aumentos de
HL y los óvulos madurarán, el ciclo suele ser cancelado. La recolección de óvulos de la
cavidad peritoneal después de la ovulación no es eficiente.
Recuperación de óvulos
La recuperación de óvulos generalmente se l eva a cabo mediante aspiración por ecografía
transvaginal, un procedimiento quirúrgico menor que se puede realizar en el consultorio del
médico o en un centro ambulatorio. Generalmente se administra alguna forma de analgesia.
de Falopio
en el ovario
Sonda de ecografía
La recuperación de óvulos se realiza generalmente a través
de la vagina con una aguja guiada por ecografía.
Una sonda de ecografía se introduce en la vagina para identificar los folículos, y una aguja
es guiada a través de la vagina y al interior de los folículos (figura 3). Los óvulos son
aspirados (retirados) de los folículos a través de la aguja conectada a un dispositivo de
succión. La remoción de múltiples óvulos puede realizarse en menos de 30 minutos.
Algunas mujeres experimentan cólicos en el día de la recuperación, pero esta sensación
generalmente desaparece al día siguiente. Las sensaciones de saciedad y/o presión pueden
durar varias semanas después del procedimiento porque los ovarios siguen agrandados.
En algunos casos, puede no tenerse acceso a uno o ambos ovarios a través de la
ecografía transvaginal. Puede utilizarse entonces una laparoscopia para recuperar los
óvulos usando un pequeño telescopio colocado en el ombligo. Para obtener más
información sobre la laparoscopia, consulte el fol eto de información para pacientes
de la ASRM titulado Laparoscopia e histeroscopia.
Fertilización y cultivo de embriones
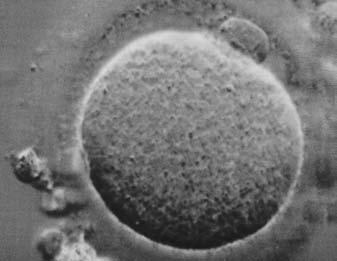
Después de que los óvulos han sido recuperados, se examinan en el laboratorio para
constatar su madurez y calidad. Los óvulos maduros (figura 4) se colocan en un medio
de cultivo de FIV y se trasfieren a una incubadora a la espera de su fertilización por el
Un óvulo maduro, sin fecundar.
El espermatozoide se separa del semen que se obtiene generalmente por la eyaculación o en
un condón especial usado durante el coito. Alternativamente, se pueden obtener
espermatozoides de los testículos o de los conductos deferentes de los hombres cuyo semen
no cuenta con espermatozoides, ya sea debido a una obstrucción o a una falta de producción.
La fertilización puede realizarse por inseminación, donde se colocan espermatozoides
con motilidad junto con los ovocitos y se incuban de la noche a la mañana o por inyección
intracitoplasmática de espermatozoides (IICE), en la que un solo espermatozoide se
inyecta directamente en cada óvulo maduro (figura 5). En los Estados Unidos, la IICE
se realiza en aproximadamente el 60% de los ciclos de TRA. La IICE generalmente se
realiza cuando existe una probabilidad de reducción de la fertilización, es decir, semen
de baja calidad, una historia de fracaso en la fertilización en un ciclo de FIV previo, etc.
Por lo general, las tasas de embarazo y parto con IICE son similares a las tasas
observadas con la FIV tradicional. Es recomendable una asesoría genética antes de la
IICE si se detectan anomalías heredadas que puedan ser transmitidas de padre a hijo.
Para obtener más información, consulte la hoja informativa de la ASRM titulada
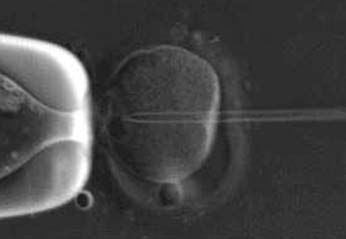
Inyección intracitoplasmática de espermatozoides.
La visualización de dos pronúcleos al día siguiente confirma la fertilización del óvulo.
Un pronúcleo se deriva del óvulo y otro del espermatozoide. Aproximadamente de 40% a
70% de los óvulos maduros se fecundan después de la inseminación o la IICE. Se pueden
presentar tasas más bajas si la calidad del espermatozoide y/o de los óvulos no es buena.
Ocasionalmente, la fertilización no ocurre en absoluto, incluso si se utilizó una IICE.
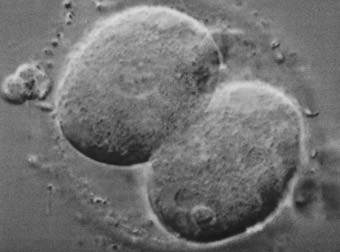
Dos días después de la recuperación del óvulo, el óvulo fecundado se divide para
convertirse en un embrión de 2 a 4 células (figura 6). En el tercer día, un embrión que
se desarrol e normalmente contendrá aproximadamente de 6 a 10 células. En el quinto
día, se forma en el embrión una cavidad con fluido, y la placenta y los tejidos fetales
se empiezan a separar. Un embrión en esta etapa se denomina blastocisto.
Los embriones pueden transferirse al útero en cualquier momento, entre uno a seis días
después de la recuperación de óvulos. Si en el útero el desarrol o sigue siendo exitoso, el
embrión eclosiona de la zona pelúcida circundante y se implanta en el revestimiento del
útero, aproximadamente de 6 a 10 días después de la recuperación del óvulo.
Tubo más grande
Tubo pequeño de
que mantiene el
vidrio a través del cual
óvulo inmóvil.
el espermatozoide se
inyecta en el óvulo.
Inyección intracitoplasmática de
espermatozoides (IICE), en la que un
espermatozoide se inyecta directamente en
un óvulo para facilitar la fertilización.
Un óvulo fecundado que se ha dividido una
vez y ahora es un embrión de dos células.
La eclosión asistida (EA) es un procedimiento de micromanipulación en el que se hace
un orificio en la zona pelúcida justo antes de la transferencia de embriones a fin de
facilitar la eclosión del embrión. Aunque no se ha demostrado definitivamente que la
EA mejore las tasas de nacidos vivos, esta técnica puede utilizarse para mujeres o parejas
de edad avanzada que han fracasado en intentos anteriores de FIV. No existe ningún
beneficio claro de la EA para mejorar el embarazo o las tasas de nacidos vivos en otros
grupos de pacientes de FIV.
El diagnóstico genético de preimplantación (DGP) se l eva a cabo en algunos centros
para la detección de enfermedades hereditarias. En el DGP, se retiran una o dos células
de los embriones en desarrol o y se les realiza una prueba para detectar una enfermedad
genética específica. Los embriones que no tienen el gen asociado con la enfermedad son
seleccionados para su transferencia al útero. Estos procedimientos requieren equipos
especializados y experiencia, además de FIV en una pareja que tal vez no necesite de
FIV para concebir.
Para algunas parejas es preferible el beneficio de examinar los embriones para
detectar una enfermedad en parejas en situación de riesgo y reducir el riesgo de tener un
hijo afectado o de poner fin a un embarazo. Aunque el DGP puede reducir la probabilidad
de iniciar un embarazo con un hijo afectado, no puede eliminar el riesgo. Sigue siendo
necesaria la confirmación con el muestreo de vel osidades coriónicas (MVC),
amniocentesis u otra prueba.
Transferencia de embriones
El siguiente paso en el proceso de FIV es la transferencia de embriones. No es necesaria
anestesia, aunque algunas mujeres tal vez deseen algún sedante suave. El médico
identifica el cuel o uterino utilizando un espéculo vaginal. Uno o más embriones en
suspensión en una gota del medio de cultivo se ponen en un catéter de transferencia, un
tubo estéril largo y delgado con una jeringa en un extremo. El médico guía suavemente
la punta del catéter de transferencia a través del cuel o uterino y coloca el líquido
que contiene los embriones en la cavidad uterina (figura 7). El procedimiento es
generalmente indoloro, aunque algunas mujeres experimentan cólicos leves.
La ASRM emite directrices relativas a la determinación del número de embriones
que deben ser considerados para la transferencia. El número de embriones transferidos
se basa principalmente en la edad de la mujer o de la donante de ovocitos que se practica
una recuperación de FIV. Estas directrices se crearon para ayudar a mantener las altas
tasas de éxito de los centros de FIV, y reducir a la vez el número de embarazos múltiples
de tipo alto (tril izos y más). El endocrinólogo reproductivo o el embriólogo discutirán
esto con la paciente antes de la transferencia.
Los embriones adicionales que queden después de la transferencia de embriones pueden ser
crioconservados (congelados) para una futura transferencia. La crioconservación hace que
los ciclos futuros de TRA sean más sencil os, menos costosos y menos invasivos que el
ciclo inicial de FIV, ya que la mujer no necesita la estimulación ovárica ni la recuperación de
óvulos. Una vez congelados, los embriones pueden ser almacenados durante varios años. Sin
embargo, no todos los embriones sobreviven al proceso de congelación y descongelamiento,
y la tasa de nacidos vivos es menor con la transferencia de embriones crioconservados. Antes
de la FIV, las parejas deben decidir si van a crioconservar embriones adicionales.
Embriones en
el catéter
Catéter de
Cuel o uterino
La transferencia de embriones se realiza a través del cuel o uterino.
VARIACIONES DE LA FIV
La transferencia intrafalopiana de gametos (TIFG) es similar a la FIV, pero los gametos
(óvulo y espermatozoide) son transferidos a las trompas de Falopio de la mujer en lugar
de hacerlo a su útero, y la fertilización tiene lugar en las trompas y no en el laboratorio.
Otra diferencia es que es necesario realizar una laparoscopia, un procedimiento
quirúrgico, para transferir el espermatozoide y el óvulo a las trompas. La TIFG es una
opción sólo para las mujeres que tienen trompas de Falopio normales. Algunas parejas
pueden considerar la TIFG por razones religiosas, ya que los óvulos no son fecundados
fuera del cuerpo. Una limitación de la TIFG es que la fertilización no se puede confirmar
como con la FIV. Hoy en día, la TIFG comprende menos del 1% de los casos de TRA
realizados en los Estados Unidos.
Otro procedimiento de TRA es la transferencia intrafalopiana del cigoto (TIFC). Esta
técnica difiere de la TIFG en que la fertilización se l eva a cabo en el laboratorio y no en
la trompa de Falopio, pero es similar en que el óvulo fecundado se transfiere a la trompa
y no al útero. Para este procedimiento también es necesario realizar una laparoscopia.
Hoy en día, la TIFC comprende menos del 1.5% de los casos de TRA realizados en los
Estados Unidos.
TASAS DE ÉXITO
Las tasas más recientes para los programas de FIV en los Estados Unidos están
disponibles en Internet en el sitio de la Society for Assisted Reproductive Technology
(SART) en www.sart.org y en el de los Centros para el Control y Prevención de
Enfermedades: www.cdc.gov/art. Aunque esta información está fácilmente disponible,
los resultados deben interpretarse con cuidado. Las tasas de éxito de un centro de FIV
dependen de una serie de factores, y la comparación de las tasas clínicas de éxito no es
significativa porque las características de las pacientes y el tratamiento varían de una
clínica a otra. Por ejemplo, el tipo de pacientes aceptadas en el programa y el número de
embriones transferidos por ciclo inciden en las estadísticas del programa. Las estadísticas
calculadas sobre un número pequeño de ciclos pueden no ser exactas. Las tasas de FIV
de un centro pueden variar drásticamente con el tiempo, y las estadísticas recopiladas
pueden no representar el éxito actual de un programa.
También es importante entender las definiciones de las tasas de embarazo y las tasas
de nacidos vivos. Por ejemplo, una tasa de embarazo del 40% no significa que el 40%
de las mujeres l even un bebé a sus casas. El embarazo no siempre resulta en bebés que
nacen vivos. Un embarazo bioquímico es un embarazo confirmado por análisis de
sangre y de orina, pero que no es visible en la ecografía, ya que el embarazo detiene
el desarrol o antes de avanzar lo suficiente como para ser visto mediante una ecografía.
Un embarazo clínico es uno que puede verse mediante ecografía, pero que detiene el
desarrol o en algún momento posterior. Por lo tanto, al comparar las tasas de "embarazo"
de los diferentes tipos de clínicas, es importante saber qué tipo de embarazo es el que se
está comparando.
La mayoría de las parejas están más interesadas en la tasa de nacidos vivos de una
clínica, que es la probabilidad de dar a luz a un niño vivo por ciclo de FIV iniciado.
Las tasas de embarazo, y lo que es más importante, las tasas de nacidos vivos, reciben
la influencia de una serie de factores, especialmente la edad de la mujer.
ESPERMATOZOIDES, ÓVULOS Y
EMBRIONES DE DONANTES
La FIV se puede hacer con los óvulos y espermatozoides de la propia pareja o con
óvulos, espermatozoides o embriones de donantes. Una pareja puede optar por utilizar
un donante si existe algún problema con sus propios espermatozoides u óvulos, o si
tienen una enfermedad genética que pueda ser transmitida a un niño. Los donantes
pueden ser conocidos o anónimos.
En la mayoría de los casos, los espermatozoides de los donantes se obtienen de un
banco de semen. Los donantes de semen son sometidos a muchos análisis genéticos y
médicos, así como a pruebas de enfermedades infecciosas. El semen se congela y se
pone en cuarentena durante seis meses, al donante se le vuelven a practicar pruebas de
detección de enfermedades infecciosas, incluido el virus del SIDA, y se autoriza el uso
de los espermatozoides sólo si todas las pruebas son negativas. Los espermatozoides de
los donantes pueden ser utilizados para la inseminación o en un ciclo de TRA. Por lo
general, el uso de espermatozoides congelados en lugar de espermatozoides frescos no
reduce las tasas de éxito.
Los óvulos de donantes son una opción para las mujeres con un útero que tiene
pocas probabilidades de concebir con sus propios óvulos o es incapaz de hacerlo.
Las donantes de óvulos se someten a los mismos análisis genéticos y médicos que los
donantes de espermatozoides, aunque por el momento no es posible congelar los óvulos
y mantenerlos en cuarentena como se hace con los espermatozoides. La donante de
óvulos puede ser elegida por la pareja infértil o por el programa de TRA. Las donantes
de óvulos asumen más riesgos y molestias que los donantes de espermatozoides. En los
Estados Unidos, las donantes de óvulos seleccionadas por programas de TRA reciben
por lo general una compensación monetaria por su participación.
La donación de óvulos es más compleja que la donación de espermatozoides y se
hace como parte de un procedimiento de FIV. La donante de óvulos debe someterse a la
estimulación ovárica y a la recuperación de óvulos. Durante este tiempo, la receptora
(la mujer que recibirá los óvulos después de que hayan sido fecundados) recibe
medicamentos hormonales a fin de preparar su útero para la implantación. Después de
la recuperación, los óvulos de la donante son fecundados por el espermatozoide de la
pareja de la receptora y se transferirán al útero de la receptora. La receptora no estará
genéticamente relacionada con el niño, pero el a l evará el embarazo y dará a luz.
La donación de óvulos es costosa porque la selección de donantes, los análisis y los
tratamientos añaden costos adicionales al procedimiento de FIV. Sin embargo, la tasa
relativamente alta de nacidos vivos a partir de la donación de óvulos, aproximadamente
el 50% a nivel nacional, ofrece a muchas parejas sus mejores posibilidades de éxito.
En general, en los Estados Unidos los óvulos de donantes se utilizan en casi el 10% de
todos los ciclos de TRA.
En algunos casos, cuando tanto el hombre como la mujer son infértiles, se han
utilizado espermatozoides y óvulos de donantes. Los embriones de donantes también se
pueden utilizar en estos casos. Algunos programas de FIV permiten a las parejas donar
sus embriones congelados no utilizados a otras parejas infértiles. El análisis apropiado
de las personas cuyos embriones genéticos se utilizaron para crear estos embriones
deberá ajustarse a las directrices federales y estatales.
La utilización de espermatozoides, óvulos o embriones de donantes es un asunto
complicado que tiene repercusiones para toda la vida. Hablar con un consejero capacitado
que comprenda los temas relacionados con los donantes puede ser muy útil en el proceso
de toma de decisiones. Muchos programas cuentan con un profesional de salud mental
en el personal o el médico puede recomendarle uno. Si una pareja conoce al donante, su
médico puede sugerir que tanto la pareja como el donante hablen con un consejero y un
abogado. Algunos estados exigen, y la mayoría de los centros de FIV recomiendan, que
un abogado presente la documentación de la pareja en el tribunal cuando se utilizan
gametos o embriones de donantes.
MADRE SUSTITUTA/PORTADORA GESTACIONAL
Un embarazo puede ser l evado por la donante de óvulos (madre sustituta tradicional) o por
otra mujer que no tiene relación genética con el bebé (portadora gestacional). Si el embrión
va a ser l evado por una madre sustituta, el embarazo se puede lograr únicamente por medio
de la inseminación o a través de TRA. La madre sustituta estará biológicamente relacionada
con el niño. Si el embrión es l evado por una portadora gestacional, los óvulos se retiran de
la mujer infértil, se fecundan con el espermatozoide de su pareja, y se trasladan al útero de
la portadora gestacional. La portadora gestacional no estará genéticamente relacionada con
el niño. Todas las partes se benefician del asesoramiento psicológico y jurídico antes de
decidirse por la madre sustituta o la portadora gestacional.
RIESGOS DE LOS PROCEDIMIENTOS DE TRA
Los riesgos médicos de las TRA dependen de cada paso específico del procedimiento.
Los siguientes son algunos de los principales riesgos de los procedimientos de TRA.
La estimulación ovárica conl eva un riesgo de hiperestimulación que ocasiona
inflamación y dolor en los ovarios. Se puede acumular líquido en la cavidad abdominal
y el pecho, y la paciente puede sentirse hinchada, con náuseas, experimentar vómitos o
falta de apetito. Hasta un 30% de las pacientes sometidas a estimulación ovárica muestran
un leve caso de síndrome de hiperestimulación ovárica (SHO) que puede ser manejado12
con analgésicos de venta libre y una reducción de la actividad. En casos moderados de
SHO, las pacientes desarrol an o acumulan líquido en la cavidad abdominal y pueden
aparecer síntomas gastrointestinales. Estas mujeres son supervisadas de cerca, pero en
general evolucionan muy bien con un manejo ambulatorio simple. El trastorno tiende
a resolverse sin necesidad de intervención a menos que se produzca el embarazo, en
cuyo caso la recuperación puede demorarse varias semanas. Hasta el 2% de las pacientes
desarrol an SHO grave, caracterizado por aumento de peso excesivo, acumulación de
líquido en el abdomen y el pecho, alteraciones de electrolitos, exceso de concentración
de la sangre y, rara vez, el desarrol o de coágulos de sangre, insuficiencia renal o muerte.
Puede ser médicamente necesario drenar con una aguja el líquido del abdomen si la
respiración se vuelve difícil. Las pacientes con SHO grave requieren hospitalización
hasta que los síntomas mejoren. Si se produce el embarazo, el SHO puede empeorar.
En ocasiones, debe considerarse la interrupción del embarazo en los casos más graves.
Aunque informes iniciales sugerían que las mujeres que usan fármacos para la
fertilidad tienen un mayor riesgo de cáncer de ovario, numerosos estudios recientes
apoyan la conclusión de que los fármacos para la fertilidad no están relacionados con el
cáncer de ovario. Sin embargo, aún hay incertidumbre acerca de si existe un riesgo y la
investigación continúa para tratar esta cuestión. Se recomienda una visita ginecológica
anual para todas las mujeres, con examen de los ovarios, independientemente del uso
anterior de medicamentos para la ovulación.
Existen riesgos relacionados con el procedimiento de recuperación de óvulos. La
laparoscopia conl eva los riesgos inherentes a cualquier cirugía que requiera anestesia.
La remoción de los óvulos a través de una aspiración con aguja conl eva un pequeño
riesgo de sangrado, infección y lesión intestinal, de la vejiga o de un vaso sanguíneo.
Esto es cierto, bien sea que el médico utilice la laparoscopia o la ecografía para guiar
la aguja. Menos de una de cada 1,000 pacientes necesitará una cirugía mayor para
reparar las lesiones causadas por las complicaciones del procedimiento de recuperación
de óvulos. En raros casos, puede producirse una infección a partir de la recuperación
o la transferencia de embriones.
La probabilidad de embarazo múltiple se incrementa en todas las tecnologías
de reproducción asistida cuando se transfiere más de un embrión. Aunque algunos
considerarían que los gemelos representan un resultado feliz, existen muchos problemas
asociados con los nacimientos múltiples, y los problemas se vuelven cada vez más graves
y comunes con tril izos y con cada feto adicional. Las mujeres con un embarazo múltiple
pueden tener que pasar semanas o incluso meses en la cama o en el hospital como una
manera de retrasar un parto prematuro. El riesgo de parto prematuro en los embarazos
múltiples es alto, y los bebés pueden nacer demasiado pronto para lograr sobrevivir.
Los bebés prematuros requieren de cuidados intensivos y prolongados, y corren el riesgo
de tener impedimentos permanentes debido a su nacimiento prematuro. Algunas parejas
pueden considerar la reducción del embarazo multifetal para disminuir los riesgos que
surgen de los embarazos múltiples, pero es probable que esta sea una decisión difícil.
Para obtener más información sobre este tema, consulte el fol eto de información para
pacientes de la ASRM titulado La gestación múltiple y la hoja informativa para
pacientes titulada Complicaciones de la gestación múltiple. Los datos también
sugieren que las concepciones mediante FIV, incluso las de bebés únicos, tienen un
riesgo ligeramente mayor de un parto prematuro o de bajo peso al nacer.
Un sangrado durante el primer trimestre puede ser indicio de un posible
aborto espontáneo o un embarazo ectópico. Si se produce sangrado o dolor
(antes de 13 semanas), es necesaria una evaluación médica para determinar la causa.
Algunas pruebas sugieren que el sangrado temprano es más común en mujeres que se
someten a FIV y TIFG, y no está asociado con el mismo mal pronóstico que se da en las
mujeres que conciben espontáneamente.
Puede producirse un aborto espontáneo después de las TRA, incluso después de que la
ecografía identifica un embarazo en el útero. El aborto espontáneo se produce después de
la ecografía en casi el 15% de las mujeres menores de 35 años, en el 25% a la edad de
40, y en el 35% a los 42 años después de los procedimientos de TRA. Además, existe
aproximadamente un 5% de posibilidades de embarazo ectópico con las TRA.
No está claro si el riesgo de defectos congénitos se incrementa con la FIV. La
mayoría de los estudios no muestra un aumento del riesgo, pero varios estudios sí.
Se están realizando investigaciones para determinar la magnitud de este riesgo, si es
que existe. Además, cuando la IICE se utiliza en casos de infertilidad masculina grave,
una causa genética de la infertilidad masculina puede ser transmitida a la descendencia.
Las tecnologías de reproducción asistida implican un importante compromiso físico,
financiero y emocional por parte de la pareja. El estrés psicológico es común y algunas
parejas describen la experiencia como una montaña rusa emocional. Los tratamientos
son complejos y costosos. Las pacientes tienen grandes expectativas, pero el fracaso
es común en cualquier ciclo. Las parejas pueden sentirse frustradas, enojadas, aisladas
y resentidas. A veces, la frustración puede conducir a la depresión y a la presencia de
sentimientos de baja autoestima, especialmente en el período inmediatamente posterior
a un intento fal ido de TRA. El apoyo de los amigos y familiares es muy importante en
este momento. Se recomienda a las parejas que consideren el asesoramiento psicológico
como medio adicional de apoyo y de manejo del estrés. Muchos programas tienen un
profesional de salud mental en el personal para ayudar a las parejas con el manejo del
dolor, la tensión o la ansiedad asociada a la infertilidad y a su tratamiento.
PREPARACIÓN PARA UN PROCEDIMIENTO DE TRA
La preparación preliminar para un procedimiento de TRA puede ser tan importante como
el procedimiento mismo. Pueden recomendarse pruebas de reserva ovárica a fin de
predecir cómo responderán los ovarios a los medicamentos para la fertilidad. La
probabilidad de éxito puede ser baja; por ejemplo, si las pruebas demuestran disminución
de la reserva ovárica o del potencial de fertilidad. La reserva ovárica puede determinarse
por la medición de los niveles de la HFE y de estradiol en el segundo o tercer día de un
ciclo menstrual, la realización de una prueba de provocación con clomifeno o contando
el número de folículos iniciales en el ovario (conteo de folículos antrales). Un nivel
elevado de HFE y/o de estradiol se asocia con una reducción de las tasas de embarazo,
especialmente en mujeres de más de 35 años de edad. Puede ser necesario corregir
anomalías de la cavidad uterina, tales como fibromas, pólipos o un septo antes de la FIV
o la TIFG. Un hidrosálpinx, una trompa de Falopio l ena de líquido o bloqueada, reduce
el éxito de la FIV. Algunos médicos recomiendan el cierre o la supresión de la trompa
afectada antes de la FIV. Para obtener más información, consulte la hoja informativa
para pacientes de la ASRM titulada Hidrosálpinx.
Al semen se le hacen pruebas antes de las TRA. Si se detectan anomalías en el semen,
la consulta con un especialista en infertilidad masculina debe determinar si hay problemas
corregibles o inquietudes subyacentes de salud. Por ejemplo, anomalías genéticas en el
cromosoma Y se han vinculado con algunos casos de infertilidad masculina, y los hombres
que nacen sin un conducto deferente, un tubo que transporta el semen desde los testículos,14
son a menudo portadores de un gen que causa la fibrosis quística. En estas circunstancias,
puede ser aconsejable la realización de pruebas genéticas.
Se han obtenido importantes avances en el tratamiento de la infertilidad masculina
y la FIV puede ayudar a algunos hombres que antes se consideraban estériles. La
consulta con un especialista en infertilidad masculina es fundamental. Cuando el semen
no puede recogerse por medio de la masturbación, existen métodos efectivos para este
propósito, como la electroeyaculación (EEY), aspiración epididimaria microquirúrgica
de espermatozoides (AEME), aspiración epididimaria percutánea de espermatozoides
(AEPE) o la extracción testicular de semen (ETS). La EEY puede ser una forma eficaz
de recoger el semen en hombres con lesiones de la médula espinal. Durante la EEY,
los impulsos eléctricos de una sonda colocada en el recto, cerca de la próstata, a menudo
logran la eyaculación. La AEME se puede realizar para recuperar los espermatozoides
después de la vasectomía o de una inversión fal ida de la vasectomía y en algunos
hombres con ausencia de conductos deferentes. La ETS implica una biopsia testicular
y la recuperación de espermatozoides directamente del tejido testicular y se puede
realizar en un consultorio con anestesia local. Los espermatozoides obtenidos por estos
métodos pueden ser congelados, almacenados y luego descongelados para las TRA.
Algunos asuntos de estilo de vida deben abordarse antes de las TRA. Fumar, por
ejemplo, puede reducir en una mujer la probabilidad de éxito hasta en un 50%. Todos
los medicamentos, incluidos los suplementos de venta libre, deben revisarse, ya que
algunos pueden tener efectos perjudiciales. El alcohol y las drogas recreativas pueden
ser perjudiciales y debe evitarse el consumo excesivo de cafeína. Dado que el ácido
fólico tomado antes del embarazo reduce el riesgo de defectos del conducto neural, tales
como la espina bífida, las mujeres deben tomar vitaminas prenatales que contengan al
menos 400 microgramos de ácido fólico antes de comenzar un ciclo de TRA. Un examen
completo y la prueba de Papanicolaou pueden identificar problemas que deben ser
tratados antes del embarazo.
Es útil un examen detal ado de los beneficios del seguro para TRA. Incluso si un
procedimiento de TRA está excluido de una póliza, puede existir disponibilidad de
cobertura para algunos aspectos de estos procedimientos. Las parejas deben consultar
previamente con el director de beneficios de sus empresas, ya que pueden estar
disponibles opciones como una cuenta de ahorros médicos. También es importante
determinar los costos para el ciclo de TRA. Tenga en cuenta que los honorarios de
la consulta inicial, las pruebas de selección, los medicamentos y procedimientos
especiales, como la IICE y la crioconservación, pueden no estar incluidos en la
cotización. Otros gastos que se deben considerar incluyen viajes, alojamiento y el
tiempo perdido de trabajo.
SELECCIÓN DE UN PROGRAMA DE TRA
Al seleccionar un programa de TRA, la información es crucial. Algunos puntos
importantes para considerar incluyen el entrenamiento y la experiencia del personal,
los tipos de pacientes en tratamiento, los servicios de apoyo disponibles, el costo,
la conveniencia, las tasas de nacidos vivos por ciclo de TRA iniciado y las tasas de
embarazos múltiples. Los programas más antiguos han establecido tasas de nacidos
vivos sobre la base de años de experiencia. Los programas pequeños y nuevos pueden
estar determinando todavía sus tasas de nacidos vivos, aunque su personal puede estar
igualmente bien calificado.
Cada pareja quiere utilizar el programa de TRA más exitoso, pero hay muchos
factores que contribuyen al éxito general de un programa. Por ejemplo, algunas clínicas
pueden estar dispuestas a aceptar pacientes con escasas posibilidades de éxito. Una
clínica puede especializarse en determinados tipos de tratamiento de la infertilidad.
Los costos pueden variar entre los programas. Una pareja puede preferir un programa
basado en interacciones interpersonales con el equipo de TRA, o puede sentirse más
confiada en el plan de tratamiento recomendado. En consecuencia, no es apropiado
comparar programas en función únicamente de las tasas de embarazo publicadas.
La credibilidad también es importante. ¿Se adhiere el programa a las directrices
establecidas por la American Society for Reproductive Medicine (ASRM)? ¿El programa
es miembro de SART, una sociedad afiliada a la ASRM? ¿Está acreditado el laboratorio
de FIV por el Colegio Estadounidense de Patólogos o por la Comisión Conjunta? Estas
organizaciones les exigen a los programas de TRA contar con personal que haya recibido
capacitación en endocrinología reproductiva, cirugía laparoscópica, ecografía, medición
de hormonas, técnica de cultivo de tejidos e interacción de espermatozoides y óvulos.
¿Está certificada la junta de médicos en endocrinología reproductiva e infertilidad?
¿Informa el programa sus resultados a SART/CDC? Los resultados compilados se
publican en la revista Fertility and Sterility, la publicación de la ASRM, y los
resultados están disponibles en el sitio web de la SART www.sart.org y en el sitio
web de los CDC en: www.cdc.gov/art.
Las consideraciones anteriores y las respuestas a las siguientes preguntas, que podrán
formularse para cada programa, le ayudarán a tomar una decisión informada a la hora de
elegir un programa de TRA.
Costo y conveniencia
• ¿Qué pruebas de selección previas al ciclo son necesarias? ¿Cuánto cuestan?
¿Proporciona mi seguro cobertura para estas pruebas?
• ¿Cuánto cuesta el procedimiento de TRA, incluidos los fármacos por ciclo de
• ¿Debo pagar por adelantado? ¿Cuánto? ¿Cuáles son los métodos de pago?
• Si es del caso, ¿presentarán alguna factura a mi compañía de seguros?
• ¿Cuánto tengo que pagar si mi ciclo de tratamiento se cancela antes de la
recuperación de óvulos? ¿Antes de la transferencia de embriones?
• ¿Cuáles son los costos de la congelación, el almacenamiento y la transferencia
de los embriones?
• ¿Cuánto tiempo de trabajo voy a perder? ¿Cuánto perderá mi pareja?
• ¿Ayudarán a conseguir alojamiento (de bajo costo), si fuera necesario?
Detal es sobre el programa
• ¿Es el programa miembro de la Society for Assisted Reproductive Technology (SART)?
• ¿Cumple y sigue el programa las directrices de ASRM/SART?
• ¿Informa el programa sus resultados a SART/CDC?
• ¿Cuántos médicos participarán en mi atención?
• ¿Están uno o más médicos de la junta certificados en endocrinología reproductiva?
• ¿Hasta qué punto puede participar mi propio médico en mi atención?
• ¿Qué tipo de asesoramiento y servicios de apoyo están disponibles?
• ¿A quién debo l amar de día o de noche si tengo un problema?
• ¿Congelan los embriones (crioconservación)?
• ¿Hay espermatozoides de donantes disponibles en su programa? ¿Hay óvulos de
donantes? ¿Hay embriones de donantes?
• ¿Tienen un límite de corte por edad o HFE basal?
• ¿Realizan IICE? En caso afirmativo, ¿cuándo? ¿Cuál es el costo?
• ¿Realizan la eclosión asistida? En caso afirmativo, ¿cuándo? ¿Cuál es el costo?
• ¿Cuántos óvulos/embriones se transferirían en mi caso?
• ¿Quién toma la decisión final de cancelar el ciclo si mi respuesta a la estimulación
es menor a la óptima?
El éxito del programa
La SART es una muy buena fuente de información para obtener resultados de
procedimientos de TRA de cada uno de los programas miembros en los Estados Unidos.
Esta información puede tener vigencia de un año, por lo que es importante averiguar si ha
habido cambios significativos en el programa desde el informe más reciente; esto incluye:• Cambios de personal
• Cambios en el enfoque de la estimulación ovárica, la recuperación de óvulos,
el cultivo de embriones o la transferencia de embriones
• Cambio en el número de ciclos
• Cambio en la tasa de abortos espontáneos, tasa de nacidos vivos por ciclo iniciado
o tasa de embarazos múltiples
Si un programa se refiere a una tasa de nacidos vivos por cada procedimiento,
asegúrese de que el representante del programa cuente los gemelos como un caso de
embarazo exitoso, no como dos. Al discutir los resultados recientes del programa
de TRA, tenga en cuenta que la tasa de nacidos vivos puede variar en función del
denominador utilizado; es decir, por ciclo iniciado, por recuperación o por
transferencia de embriones. Por ejemplo, las tasas de nacidos vivos por recuperación
de óvulos no consideran los ciclos cancelados, y las tasas basadas en la transferencia de
embriones no incluyen los ciclos cancelados ni las fertilizaciones fal idas. Por lo tanto,
las tasas de nacidos vivos por ciclo son mayores por recuperación de óvulos y son las
más altas por transferencia de embriones.
CUÁNDO TERMINAR EL TRATAMIENTO
Los estudios indican que la posibilidad de embarazo en ciclos consecutivos de FIV sigue
siendo similar en hasta cuatro ciclos. Sin embargo, muchos otros factores deberían tenerse
en cuenta al determinar el punto final apropiado para el tratamiento, incluidas las reservas
financieras y psicológicas. Los miembros del equipo de FIV pueden ayudar a las parejas a
decidir cuándo dejar el tratamiento y examinar otras opciones, tales como la donación de
óvulos y/o de espermatozoides o la adopción, cuando sea del caso. El médico, los grupos
de apoyo y otras parejas que siguen el tratamiento para la infertilidad pueden proporcionar
valioso apoyo y orientación.
La decisión de buscar tratamiento para la infertilidad es viable debido a las tecnologías de
reproducción asistida disponibles en la actualidad. Con paciencia, una actitud positiva y el tratamiento
apropiado, la mayoría de las parejas infértiles finalmente disfrutarán de las alegrías de la paternidad.
Para obtener información adicional,
visite www.sart.org y www.cdc.gov/art.
Agonistas de HLGn. Un análogo HLGn que inicialmente estimula a la glándula
pituitaria a liberar HL y HFE, seguido de un efecto supresor retrasado. También
se utiliza para ayudar a estimular el crecimiento del folículo, cuando se inicia a
comienzos de un ciclo de FIV.
American Society for Reproductive Medicine (Sociedad Americana de
Medicina Reproductiva) (ASRM). Una organización médica profesional con más
de 8,000 profesionales de atención médica dedicada a la medicina reproductiva.
Amniocentesis. Un procedimiento en el que una pequeña cantidad de líquido amniótico
se extrae a través de una aguja desde el saco fetal, alrededor de 16 semanas después de
iniciado un embarazo. El líquido se estudia en busca de anomalías cromosómicas o de
otro tipo que puedan afectar el desarrol o fetal.
Análogos HLGn. Hormonas sintéticas similares a la hormona liberadora de
gonadotropina de origen natural, utilizadas para prevenir la ovulación prematura.
Hay dos tipos de análogos HLGn: Agonistas de HLGn y antagonistas de HLGn.
Antagonistas de HLGn. Hormonas sintéticas similares a la hormona liberadora
de gonadotropina de origen natural, utilizadas para prevenir la ovulación prematura.
Estos medicamentos tienen un efecto supresivo inmediato sobre la glándula pituitaria.
Aspiración epididimaria microquirúrgica de espermatozoides (AEME). Procedimiento
microquirúrgico ambulatorio utilizado para recoger espermatozoides en hombres con
obstrucción de los conductos reproductores masculinos, como en el caso de una
vasectomía previa o la ausencia de conductos deferentes. Utilizada en los procedimientos
de FIV-IICE.
Aspiración epididimaria percutánea de espermatozoides (AEPE). Un procedimiento
de aspiración de espermatozoides en el que una aguja se inserta en el epidídimo
(glándula que l eva el semen de los testículos a los conductos deferentes) a fin de
recuperar los espermatozoides para su uso en un procedimiento de FIV.
Aspiración por ecografía transvaginal. Una técnica guiada por ecografía para la
recuperación de óvulos en la cual se pasa una aguja larga y delgada a través de
la vagina hasta el folículo ovárico y se aplica succión para lograr la recuperación.
Blastocisto. Un embrión que ha formado una cavidad l ena de fluido y en el que las
células comienzan a formar la primera placenta y el embrión, por lo general 5 días
después de la ovulación o la recuperación de un óvulo.
Canal cervical. El conducto que va de la vagina al útero.
Centros para el Control y Prevención de Enfermedades. Organismo federal para
la protección de la salud y la seguridad de las personas en el país y en el extranjero,
que proporciona información fidedigna a fin de mejorar las decisiones de salud y
promocionar la salud a través de asociaciones sólidas.
Cigoto. Un óvulo fecundado antes de que comience la división celular.
Citrato de clomifeno. Una fármaco oral antiestrógeno utilizado para inducir la ovulación.
Clomid® y Serophene® son marcas registradas.
Conductos deferentes. Los dos conductos musculares que transportan los
espermatozoides desde el epidídimo hasta la uretra.
Conteo de folículos antrales. El número de folículos observados por ecografía
al principio del ciclo menstrual, por lo general en el día 2 ó 3.
Crioconservación. Congelación a muy baja temperatura; por ejemplo, en
nitrógeno líquido (-196 °C) para mantener la viabilidad de los embriones,
óvulos o espermatozoides.
18
Cuel o uterino. El extremo angosto, inferior del útero.
Cultivo de embriones. Crecimiento del embrión en una placa de laboratorio (cultivo).
Diagnóstico genético de preimplantación (DGP). Una prueba realizada por un
embriólogo en la que una o dos células se extraen de un embrión. Las células son luego
examinadas para detectar anomalías genéticas. El DGP se puede realizar en conjunto
Eclosión asistida (EA). Un procedimiento en el que la zona pelúcida (cubierta externa)
del embrión se abre parcialmente, por lo general mediante la aplicación de un ácido
o de láser, para facilitar la implantación del embrión y el embarazo.
Ecografía. Una tecnología que utiliza ondas sonoras de alta frecuencia para formar una
imagen de los órganos internos en la pantal a de un monitor, utilizada por los
especialistas en fertilidad para monitorear el crecimiento de los folículos ováricos,
para recuperar los óvulos de los folículos y evaluar un embarazo.
Electroeyaculación (EEY). Procedimiento que causa la eyaculación de semen, l evado
a cabo por la estimulación eléctrica de los tejidos en la región de la próstata.
Embarazo bioquímico. Cuando la prueba de embarazo de una paciente es inicialmente
positiva, pero se convierte en negativa antes de que un saco gestacional sea visible en
la ecografía.
Embarazo clínico. Un embarazo confirmado por un creciente nivel de GCh y la
presencia de un saco gestacional detectado por ecografía.
Embarazo ectópico. Un embarazo que se ubica en las trompas de Falopio o en otro
lugar fuera del revestimiento del útero.
Embrión. Un óvulo fecundado que ha iniciado la división celular.
Endometriosis. Una enfermedad en la que un tejido que se asemeja al endometrio
(el revestimiento del útero) crece por fuera del útero. A menudo se asocia con la
Espermatozoide. La célula reproductiva masculina que fecunda al óvulo de la mujer.
La cabeza del espermatozoide l eva el material genético (cromosomas), la parte media
produce energía para el movimiento y la cola larga y delgada serpentea para propulsar
el espermatozoide.
Espina bífida. Un defecto de nacimiento de la columna vertebral. La espina bífida es
la incapacidad de la columna vertebral para cerrarse correctamente durante el desarrol o.
Estimulación ovárica. Véase Inducción de la ovulación.
Estradiol. El principal estrógeno (hormona) producido por las células de los folículos
Estrógeno. La hormona femenina que es responsable en gran medida del engrosamiento
del revestimiento uterino durante la primera mitad del ciclo menstrual, en preparación
para la ovulación y el posible embarazo. El estradiol es el principal estrógeno.
Extracción espermática testicular (EET). Remoción operativa del tejido testicular en un
intento de reunir espermatozoides vivos para su uso en un procedimiento de FIV-IICE.
Factor masculino. Infertilidad causada por un problema en el hombre, por ejemplo,
la incapacidad de eyacular o un número insuficiente de espermatozoides.
Fertilización. La fusión del espermatozoide y el óvulo.
Fertilización in vitro (FIV). Un proceso en el que un óvulo y un espermatozoide se
combinan en una placa de laboratorio para facilitar la fertilización. Si se produce la
fertilización, el embrión resultante se transfiere al útero de la mujer.
Fibromas. Tumores benignos (no cancerosos) de la pared del músculo uterino que
pueden causar sangrado uterino anormal y dolor.
Folículo. Una estructura l ena de fluido presente en el ovario que contiene un óvulo
y las células circundantes que producen hormonas. A medida que el folículo madura,
el líquido puede verse por ecografía.
Glándula pituitaria. Una pequeña glándula ubicada justo debajo del hipotálamo
en el cerebro que segrega la hormona foliculoestimulante (HFE) y la hormona
luteinizante (HL).
Gonadotropina coriónica humana (GCh). Una hormona producida por la placenta,
cuya detección es la base para la mayoría de las pruebas de embarazo. También se refiere
a la medicación utilizada durante la inducción de la ovulación para provocar la ovulación
y las fases finales de maduración de los óvulos.
Gonadotropina menopáusica humana (GMh). Un fármaco para la ovulación que
contiene hormona foliculoestimulante (HFE) y hormona luteinizante (HL) derivadas de
la orina de mujeres posmenopáusicas. La GMh se utiliza para estimular el crecimiento
de múltiples folículos.
Hidrosálpinx. Una trompa de Falopio bloqueada, dilatada, l ena de líquido.
Hormona foliculoestimulante (HFE). La hormona pituitaria responsable de estimular
el crecimiento del folículo que rodea al óvulo. Además, la hormona presente en los
fármacos inyectables de ovulación que promueve el crecimiento de los folículos.
Hormona liberadora de gonadotropina (HLGn). Hormona secretada por el hipotálamo,
un centro de control ubicado en el cerebro, que induce a la glándula pituitaria a liberar
HFE y HL al torrente sanguíneo.
Hormona luteinizante (HL). La hormona pituitaria que normalmente ocasiona la
ovulación y la maduración de los óvulos.
Inducción de la ovulación. La administración de medicamentos hormonales (fármacos
para la ovulación) que estimulan a los ovarios a producir múltiples óvulos. A veces se
le denomina reclutamiento folicular aumentado o hiperestimulación ovárica controlada.
Inseminación. Colocación de los espermatozoides en el útero o el cuel o uterino para
producir un embarazo, o la adición de espermatozoides a los óvulos en los
procedimientos de FIV.
Inyección intracitoplasmática de espermatozoides (ICSI). Un procedimiento de
micromanipulación en el que un solo espermatozoide se inyecta directamente en un
óvulo para intentar que se produzca la fertilización; este procedimiento se utiliza con la
infertilidad masculina o con parejas con intentos previos fal idos de fertilización por FIV.
Laparoscopia. Un procedimiento quirúrgico que permite la visualización de los órganos
pélvicos internos. Durante el procedimiento, un instrumento largo y estrecho de fibra
óptica, l amado laparoscopio, se inserta generalmente a través de una incisión en o por
debajo del ombligo de la mujer. Pueden hacerse una o más incisiones para la inserción
de instrumentos adicionales.
Madre sustituta tradicional. Una mujer que l eva un embarazo destinado a otra familia,
en el que la concepción resulta del espermatozoide de la pareja de la mujer infértil y su
propio ovocito.
Medio de cultivo FIV. Un líquido especial en el que se mantienen los espermatozoides,
los óvulos y los embriones cuando están por fuera del cuerpo humano.
Micromanipulación. Proceso de laboratorio en la FIV por el cual el óvulo o embrión
se sostiene con instrumentos especiales y se altera quirúrgicamente mediante
procedimientos como la inyección intracitoplasmática de espermatozoides (IICE),
la eclosión asistida o la biopsia del embrión.
Mucosa cervical. La sustancia presente en el cuel o uterino a través de la cual los
espermatozoides deben nadar con el fin de entrar en el útero.
Ovario (Ovarios). Las dos glándulas sexuales femeninas ubicadas en la pelvis, que
se encuentran una a cada lado del útero. Los ovarios producen óvulos y hormonas,
incluidos estrógeno, progesterona y andrógenos.
Ovocito. Término médico para el óvulo, el gameto femenino. También l amados óvulos.
Ovulación. Liberación de un óvulo desde el ovario.
Óvulo (ovocito). Células sexuales femeninas (óvulos) producidas por el ovario, las
cuales, cuando son fecundadas por un espermatozoide del hombre, producen embriones.
Pólipos. Un término general que describe cualquier masa de tejido que sobresalga o se
proyecte hacia el exterior o hacia arriba del nivel normal de la superficie.
Portadora gestacional. Una mujer que l eva el embarazo de otra pareja. El embarazo
se deriva del óvulo y el espermatozoide de la pareja. A pesar de que l eva el embarazo
a término no tiene una relación genética con el niño resultante.
Preparación de los espermatozoides. Un procedimiento para remover el fluido seminal
de las células de los espermatozoides.
Progesterona. Una hormona femenina secretada durante la segunda mitad del ciclo
menstrual. Prepara el revestimiento del útero para la implantación de un óvulo fecundado.
Pronúcleo. El núcleo de un gameto masculino o femenino (óvulo o espermatozoide)
visto en el embrión unicelular (cigoto).
Prueba de provocación con clomifeno. Una prueba de la reserva ovárica en la que
se verifica en suero la HFE en los días 3 y 10 del ciclo menstrual y se toma citrato de
clomifeno en los días 5 al 9.
Recuperación de óvulos. Procedimiento en el que se obtienen los óvulos mediante la
inserción de una aguja en el folículo ovárico y se remueven por succión el líquido y el
óvulo. También l amada aspiración de ovocitos.
Reducción del embarazo multifetal. También conocida como reducción selectiva.
Un procedimiento para reducir el número de fetos en el útero. Este procedimiento se
l eva a cabo a veces en mujeres que están embarazadas con múltiples fetos y que tienen
un mayor riesgo de aborto espontáneo posterior o de parto prematuro. Estos riesgos
aumentan con el número de fetos.
Reserva ovárica. El potencial de fertilidad de una mujer en ausencia de cambios
fisiopatológicos específicos en su aparato reproductor. La disminución de la reserva
ovárica se asocia con la disminución en el número de óvulos y el empeoramiento de
la calidad de los ovocitos.
Semen. El líquido en el que se encuentran los espermatozoides.
Septo, uterino. Una banda de tejido fibroso presente desde el nacimiento que forma
una pared que se extiende desde la parte superior de la cavidad uterina. Un septo puede
aumentar el riesgo de aborto involuntario y otras complicaciones del embarazo.
Síndrome de hiperestimulación ovárica (SHO). Un trastorno que puede resultar de
la inducción de la ovulación y que se caracteriza por el agrandamiento de los ovarios,
la retención de líquidos y el aumento de peso.
Society for Assisted Reproductive Technology (SART) (Sociedad para la Tecnología de
Reproducción Asistida). Una sociedad afiliada a la ASRM e integrada por representantes
de los programas de tecnología de reproducción asistida que han demostrado su
capacidad para realizar la FIV.
Tecnologías de Reproducción Asistida (TRA). Todos los tratamientos que incluyen
la manipulación de óvulos y/o embriones. Algunos ejemplos de TRA son la fertilización
in vitro (FIV), la transferencia intrafalopiana de gametos (TIFG), la transferencia de
pronúcleos a las trompas (TPT), la transferencia de embriones a las trompas (TET)
y la transferencia intrafalopiana de cigotos (TIFC).
Transferencia de embriones. Implante de un embrión en el útero o, en el caso de
TIFC y TET, en la trompa de Falopio.
Transferencia de embriones a las trompas (TET). Un proceso en el que un embrión
en su fase inicial se transfiere a la trompa de Falopio.
Transferencia intrafalopiana de cigotos (TIFC). El óvulo se fecunda en el laboratorio
y el cigoto se transfiere a la trompa de Falopio en la etapa pronuclear antes de que la
división celular tenga lugar. Los óvulos son recuperados y fecundados un día y el
embrión se transfiere al día siguiente.
Transferencia intrafalopiana de gametos (TIFG). La transferencia directa de
espermatozoides y óvulos a las trompas de Falopio. La fertilización se l eva a cabo
en el interior de la trompa.
Trompas de Falopio. Un par de conductos unidos al útero, uno a cada lado, donde
el espermatozoide y el óvulo se unen en la concepción normal.
Útero (matriz). El órgano reproductor femenino ubicado en la pelvis, ahuecado
y muscular, en donde el embrión se implanta y crece durante el embarazo. El
revestimiento del útero, l amado endometrio, produce el flujo de sangre menstrual
mensual cuando no se produce el embarazo.
Vagina. El canal en la mujer que l eva al cuel o uterino, el cual a su vez conduce al útero.
Zona pelúcida. La capa exterior del óvulo que un espermatozoide debe penetrar para
fecundar el óvulo.
Díganos su opinión
Envíe sus comentarios sobre este fol eto por correo electrónico a [email protected].
En la casil a de asunto, escriba "Atención: Comité de Educación del Paciente"
Para obtener una lista de materiales de lectura adicionales, comuníquese con la Oficina
Administrativa de la ASRM en 1209 Montgomery Highway, Birmingham,
Alabama 35216-2809; (205) 978-5000.
AMERICAN SOCIETY FOR REPRODUCTIVE MEDICINE
1209 Montgomery Highway
Birmingham, Alabama 35216-2809
(205) 978-5000 • [email protected] • www.asrm.org
Source: http://www.cerhlaguna.com/files/pdf/tecnicas_de_reproduccion_asistida.pdf
MIDWIFERY CARE FOR EARLY PREGNANCY LOSS: OPTIMIZING CLIENT CENTERED COUNSELING AND MANAGEMENT Tara Cardinal, CNM, ARNP Marnie Raelene, MSM Student Midwives Association of Washington State 2015 Spring Conference ACKNOWLEDGEMENTS Washington State Department of Health Polly Taylor, CNM, MPH Training, Education and Advocacy in Miscarriage
NGUYEN THI NGOC PHUONG PROFESSOR TREATMENT OF MENOPAUSE: HORMONAL and NON-HORMONAL THERAPY Prof. NGUYEN THI NGOC PHUONG, MD. Vice President of Vietnam Asociation of Gynecologists and Obstetricians President of Ho Chi Minh City Society for Reproductive Medicine THE FRANCE - VIETNAM – ASIA PACIFIC CONFERENCE











